MATERI OTOMOTIF MEMBAHAS BATERAI MOBIL
MATERI OTOMOTIF
MEMBAHAS BATERAI MOBIL
Baterai Mobil merupakan alat yang menyimpan energi untuk
mensuplai sistem kelistrikan mobil seperti untuk menghidupkan mobil saat awal
atau melakukan starter, sistem pengapian, sistem listrik body, sistem instrumen
mobil, sistem kelistrikan air condisionir (AC), sistem wiper,
sistem listrik power windows, sistem audio dan sistem kelistrikan lainnya. Jadi
baterai mobil sangat penting untuk dipelajari.
Gambar 1 : Baterai Mobil
Untuk memahami apa itu baterai uraian di bawah
ini akan membahas pengertian akumulator dan baterai, fungsi baterai, kontruksi
baterai, pemahaman voltage dan kapasitas baterai, jenis baterai pada kendaraan
bermotor, reaksi elektrokimia pada baterai basah, reaksi elektrokimia pada
baterai kering, pemeriksaan volume larutan elektrolit, pengukuran berat jenis
elektrolit baterai, pengukuran tegangan baterai, pengukuran arus listrik
baterai, permasalahan pada baterai mobil, perbaikan baterai, dan cara perawatan
baterai.
A. PENGERTIAN AKUMULATOR DAN BATERAI
Akumulator adalah alat yang dapat menyimpan
energi dalam bentuk kimia. Umumnya, energi ini dalam bentuk energi listrik.
Contohnya akumulator adalah baterai, kapasitor dan lainnya.
Sumber arus listrik dibedakan menjadi dua,
yaitu sumber arus listrik bolak-balik/alternating current (AC) dan
sumber arus listrik searah/dirrect current (DC). Sumber
arus listrik AC dihasilkan oleh dinamo arus AC dan generator. Ada beberapa
macam sumber arus searah, misalnya sel voltage, elemen kering (baterai),
akumulator, solar sel, dan dinamo arussearah. Elemen voltage, batu
baterai, dan akumulator merupakan sumber arus searah yang dihasilkan oleh
reaksi kimia. Oleh karena itu, elemen voltage, batu baterai, dan akumulator
sering disebut elektrokimia. Dikatakan elektrokimia sebab alat tersebut
mengubah energi kimia menjadi energi listrik. Ini adalah gambar baterai
dan kapasitor.
Gambar 2 : Baterai
Basah
Gambar 3 : Kapasitor
Baterai dan kapasitor memiliki fungsi yang
sama untuk menyimpan arus listrik (Ampere) yang diberi simbol A dan
memiliki tegangan (Voltage) yang diberi simbol V. Dalam dalam topik ini
akan membahas baterai.
B. FUNGSI BATERAI
1. Untuk menghidupkan mobil saat melakukan starter
2. Sebagai sumber arus listrik sistem pengapian
3. Sebagai sumber arus listrik sistem penerangan (untuk
menghidupkan lampu-lampu pada saat malam atau siang)
4. Untuk menghidupkan sistem instrumen mobil
5. Untuk menghidupkan sistem kelistrikan air
condisionir (AC)
6. Untuk menghidupkan sistem wiper (penghapus kaca)
7. Untuk menghidupkan sistem listrik power window
8. Untuk menghidupkan sistem audio dan sistem kelistrikan lainnya.
C. KONTRUKSI BATERAI
Baterai terdiri dari beberapa komponen antara
lain : Kotak baterai, cover, terminal baterai, elektrolit baterai, lubang
elektrolit baterai, tutup baterai dan sel baterai. Dalam satu baterai terdiri
dari beberapa sel baterai, tiap sel menghasilkan tegangan 2 - 2,1 V. Baterai 6
V terdiri dari 3 sel, baterai 12 V mempunyai 6 sel, baterai 24 volt terdiri
dari 12 sel, baterai 36 volt terdiri dari 18 sel dan 48 volt terdiri dari 24
sel baterai yang dirangkai secara seri. Lihat gambar blok sel di bawah ini :
|
|
|

Gambar 4 : Hubungan Blok Sel Baterai
(VEDC, 2004)
Tiap sel baterai mempunyai lubang untuk
mengisi elektrolit baterai dan untuk melakukan perawatan melalui membersihkan
kotoran-kotoran yang ada di dalam baterai, lubang tersebut ditutup dengan tutup
baterai, pada tutup terdapat lubang ventilasi yang digunakan untuk mengalirkan
uap dari elektrolit baterai. Tiap sel baterai terdapat plat positif, separator
dan fiberglass dan plat negatif, plat positif berwarna coklat
gelap (dark brown) dan plat negatif berwarna abu-abu metalik (metallic
gray).
Gambar 5 : Kontruksi Baterai Mobil
(Depdiknas, 2004)
D. BAGIAN-BAGIAN BATERAI DAN FUNGSINYA
Penjelasan bagian-bagian baterai dan fungsinya sebagai berikut :
1. Kotak baterai
Kotak baterai adalah wadah yang menampung
cairan elektrolit dan elemen baterai disebut kotak baterai. Ruangan di dalamnya
dibagi menjadi ruangan sesuai dengan jumlah selnya. Pada kotak baterai terdapat
garis tanda upper level dan lower level, sebagai indikator jumlah cairan
elektrolit.
Gambar 6 : Kotak Baterai
2. Cover Baterai
Cover baterai berfungsi sebagai penutup kotak baterai yang
berwarna hitam seperti pada gambar di bawah dan cover sebagai penahan terminal
positif dan terminal negatif. Cover juga terdapat lubang/tutup baterai dan
terdapat tanda berat jenis elektrolit yang berwarna merah menandakan perlu
distroom, warna putih menandakan masih baik atau bisa digunakan dan warna hijau
menandakan sangat baik.

Gambar 7 : Cover Baterai
3. Elektrolit baterai
Elektrolit adalah cairan yang dapat
menghantarkan arus listrik. Cairan air aki terdapat campuran asam sulfat dan
air. Yang mana asam sulfat 35 % dan mengandung air adalah 65 % ketika dicampur
menjadi satu maka disebut air aki.
4. Terminal baterai
Terminal adalah sumber aliran listrik yang berasal dari reaksi
kimia yang ada di dalam baterai. Yang ditandai terminal positif dan terminal
negatif.
Gambar 8 : Terminal Baterai
5. Lubang elektrolit baterai
Lubang elektrolit adalah lubang untuk mengisi
air aki dan untuk membersihkan kotoran yang ada dalam baterai ataupun untuk
perawatan bagian dalam baterai.
Gambar 9 : Lubang Elektrolit Baterai
6. Tutup Baterai
Sumbat ventilasi ialah tutup untuk lubang pengisian elektrolit
dan sumbat ini berfungsi untuk memisahkan gas hidrogen (yang terbentuk saat
pengisian) dan uap asam sulfat di dalam baterai dengan cara membiarkan gas
hidrogen keluar lewat lubang ventilasi, sedangkan uap asam sulfat mengembun
pada tepian ventilasi dan menetes kembali ke bawah bercampur lagi dengan air
aki utama.
Gambar 10 : Tutup Baterai
(Depdiknas, 2004)
7. Sel baterai.
Sel baterai adalah suatu komponen baterai berfungsi menyimpan arus
listrik sesudah terjadi reaksi kimia. Sel terdiri dari plat positif, separator
dan fiberglassdan plat negatif, plat positif berwarna coklat gelap(dark
brown) dan plat negatif berwarna abu-abu metalik (metallic gray).
Gambar 11 : Sel Baterai
(Depdiknas, 2004)
E. JENIS BATERAI PADA KENDARAAN BERMOTOR
Jenis baterai basah atau aki konvensional
yaitu Yuasa, GS, Incoe, G-Force, Massiv XP, dan Varta. Sedangkan jenis baterai
kering atau baterai maintenance free (MF) contohnya yaitu
Amaron, Delkor, FB Furukawa, G-Force, GS Astra MF, Optima, Panasonic, Rocket,
Varta dan Yuasa.
Baterai digolongkan menjadi 2 macam yaitu
sebagai berikut : 1). Valve Regulated Lead Acid yang disingkat VRLA
/ Sealed Lead Acid (SLA) atau di Negara Indonesia dikenal
dengan istilah aki/baterai kering ialah baterai tertutup (sealed).
Karena sifatnya tertutup maka uap yang keluar dari baterai sangat sedikit,
sehingga tidak perlu menambah cairan/elektrolit(electrolyte) selama
masa pemakaian baterai. 2). Vented Lead Acid yang disingkat
VLA atau di Negara Indonesia dikenal dengan istilah Aki/Baterai Basah ialah
baterai yang mengandung cairan/elektrolit (electrolyte) dan
memerlukan pengisian elektrolit (electrolyte) selama masa
pemakaian baterai tersebut.
Di bawah ini tampak gambar yang membedakan baterai basah dan
baterai kering.
Gambar 12 : Baterai Basah
Gambar 13 : Baterai Kering
(httprikkytijawz.files.wordpress.com201101aki-mf)
F. PEMAHAMAN VOLTAGE DAN KAPASITAS BATERAI
Perlu diketahui pada variabel baterai ialah
voltage dan kapasitas. Voltage (tegangan) adalah perbedaan
tegangan antara kutub positif dan kutub negatif yang memiliki satuan V(Voltage).
Perbedaan tegangan ini yang menyebabkan arus dapat mengalir. Sedangkan yang
dimaksud dengan kapasitas adalah isi baterai. Dua varibel yang sangat penting
dan saling berkaitan satu sama lainnya, yaitu waktu dan kuat arus. Kapasitas
mempunyai satuan AH(Ampere Hour). Ampere merupakan satuan kuat arus dan
hour adalah s
G. REAKSI ELEKTROKIMIA PADA BATERAI BASAH
Elemen dibedakan menjadi dua, yaitu elemen
primer dan elemen sekunder. Elemen primer adalah elemen yang setelah habis
muatannya tidak dapat diisi kembali. Contohnya elemen voltage dan batu baterai.
Elemen sekunder adalah elemen yang setelah habis muatannya dapat diisi kembali.
Contohnya akumulator (aki). Pada elemen voltage, baterai, dan akumulator
terdapat tiga bagian utama, yaitu 1) anode, elektrode positif yang memiliki
potensial tinggi, 2) katode, elektrode negatif yang memiliki potensial rendah,
dan 3) larutan elektrolit, cairan yang dapat menghantarkan arus listrik.
Akumulator sering disebut aki. Elektrode
akumulator baik anode dan katode terbuat dari timbal (Cu) berpori. Bagian utama
akumulator, yaitu :
o Kutup positif (anode) terbuat dari timbal
dioksida (PbO2),
o Kutub negatif (katode) terbuat dari timbal
murni (Pb),
o Larutan elektrolit terbuat dari asam sulfat
(H2SO4) dengan kepekatan 30%.
Lempeng timbal dioksida dan timbal murni
disusun saling bersisipan akan membentuk satu pasang sel akumulator yang saling
berdekatan dan dipisahkan oleh bahan penyekat berupa isolator. Beda potensial
yang dihasilkan setiap satu sel akumulator 2 volt. Dalam kehidupan sehari-hari,
ada akumulator 12 volt yang digunakan untuk menghidupkan starter mobil atau
untuk menghidupkan lampu sein depan dan belakang mobil. Akumulator 12 volt
tersusun dari 6 pasang sel akumulator yang disusun seri. Kemampuan akumulator
dalam mengalirkan arus listrik disebut kapasitas akumulator yang dinyatakan
dengan satuan Ampere Hour (AH). Kapasitas akumulator 60 AH artinya akumulator
mampu mengalirkan arus listrik 1 ampere yang dapat bertahan selama 60 jam tanpa
pengisian kembali.
Penjelasan prinsip kerja elektrokimia yaitu elemen voltage disimpan pada wadah yang diisi
larutan asam sulfat (H2SO4) dan dua logam tembaga (Cu) dan seng (Zn). Bagian
utama elemen Voltage, yaitu 1) kutub positif (anode) terbuat dari tembaga (Cu),
2) kutub negatif (katode) terbuat dari seng (Zn), 3) larutan elektrolit terbuat
dari asam sulfat (H2SO4).
Lempeng tembaga memiliki potensial tinggi,
sedangkan lempeng seng memiliki potensial rendah. Ketika kedua lempeng logam
dihubungkan melalui lampu, maka lampu akan menyala. sehingga membuktikan adanya
arus listrik yang mengalir pada lampu. Ketika lampu menyala, larutan elektrolit
akan bereaksi dengan logam tembaga maupun seng akan menghasilkan sejumlah
elektron yang mengalir dari seng menuju tembaga.
Gambar 14 : Lampu Menyala
Reaksi kimia pada elemen Volta adalah sebagai berikut.
o Pada larutan elektrolit terjadi reaksi H2SO4 →
2H+ + SO2–4
o Pada kutub positif terjadi reaksi Cu + 2H+ →
polarisasi H2
o Pada kutub negatif terjadi reaksi Zn + SO4 →
ZnSO4+ 2e
Kondisi baterai terjadi reaksi. Reaksi kimia
pada elemen Voltage akan menghasilkan gelembung-gelembung gas hidrogen (H2).
Gas hidrogen tidak dapat bereaksi dengan tembaga, sehingga gas hidrogen hanya
menempel dan menutupi lempeng tembaga yang bersifat isolator listrik. Dan dapat
menyebabkan terhalangnya aliran elektron dari seng menuju tembaga maupun arus
listrik dari tembaga menuju seng. Peristiwa tertutupnya lempeng tembaga oleh
gelembung-gelembung gas hidrogen disebut polarisasi. Adanya polarisasi gas
hidrogen pada lempeng tembaga menyebabkan elemen Voltage mampu mengalirkan arus
listrik hanya sebentar. Tegangan yang dihasilkan setiap elemen Voltage sekitar
2,1 volt.
Proses pengosongan, pada saat akumulator digunakan, terjadi
perubahan energi kimia menjadi energi listrik dan terjadi perubahan anode,
katode dan elektrolitnya. Pada anode terjadi perubahan yaitu timbal dioksida
(PbO2) menjadi timbal sulfat (PbSO4). Perubahan yang terjadi pada katode adalah
timbal murni (Pb) menjadi timbal sulfat (PbSO4). Adapun pada larutan elektrolit
terjadi perubahan, yaitu asam sulfat pekat menjadi encer, karena pada
pengosongan akumulator terbentuk air (H2O). Susunan akumulator adalah sebagai
berikut.
o Kutub positif (anode) terbuat dari timbal
dioksida (PbO2).
o Kutub negatif (katode) terbuat dari timbal
murni (Pb).
o Larutan elektrolit terbuat dari asam sulfat
(H2SO4) dengan kepekatan 30%.
Ketika akumulator digunakan, terjadi reaksi
antara larutan elektrolit dengan timbal dioksida dan timbal murni sehingga
menghasilkan elektron dan air. Reaksi kimia pada akumulator yang dikosongkan adalah
sebagai berikut.
o Elektrolit : H2SO4 →2H+ + SO4 2
o Anode: PbO2 + 2H+ + 2e + H2SO4 →PbSO4 + 2H2O
o Katode : Pb + SO 42 → PbSO4
Pada saat akumulator digunakan, baik anode
maupun katode perlahan - lahan akan berubah menjadi timbal sulfat (PbSO4). Jika
hal itu terjadi, maka kedua kutubnya memiliki potensial sama dan arus listrik
berhenti mengalir. Terbentuknya air pada reaksi kimia menyebabkan kepekatan
asam sulfat berkurang, sehingga mengurangi massa jenisnya. Keadaan ini
dikatakan akumulator kosong (habis).
Proses pengisian akumulator, akumulator termasuk elemen
sekunder, sehingga setelah habis bisa diisi kembali. Pengisian akumulator
sering disebut penyetruman akumulator. Pada saat penyetruman akumulator terjadi
perubahan energi listrik menjadi energi kimia. Perubahan yang terjadi pada
anode, yaitu timbal sulfat (PbSO4) berubah menjadi timbal dioksida (PbO2).
Perubahan pada anode, yaitu timbal sulfat (PbSO4) berubah menjadi timbal murni
(Pb). Kepekatan asam sulfat akan berubah dari encer menjadi pekat, karena
ketika akumulator disetrum terjadi penguapan air. Untuk menyetrum akumulator
diperlukan sumber tegangan DC lain yang memiliki beda potensial yang lebih
besar. Misalnya akumulator 12 volt kosong harus disetrum dengan sumber arus
yang tegangannya lebih dari 12 volt. Kutub - kutub akumulator dihubungkan
dengan kutub sumber tegangan. Kutub positif sumber tegangan dihubungkan dengan
kutub positif akumulator. Adapun, kutub negatif sumber tegangan dihubungkan dengan
kutub negatif akumulator. Rangkaian ini menyebabkan aliran elektron sumber
tegangan DC berlawanan dengan arah aliran elektron akumulator. Bagaimanakah
cara menyetrum akumulator lihat pada gambar di bawah ini :
Gambar 15 : Cara Menyetrum aki
Elektron - elektron pada akumulator dipaksa
kembali ke elektrode akumulator semula, sehingga dapat membalik reaksi kimia
pada kedua elektrodenya. Agar hasil penyetruman akumulator lebih baik, maka
arus yang digunakan untuk mengisi kecil dan waktu pengisian lama. Besarnya arus
listrik diatur dengan reostat. Pada saat pengisian terjadi penguapan asam
sulfat, sehingga menambah kepekatan asam sulfat dan permukaan asam sulfat
turun. Oleh sebab itu, perlu ditambah air akumulator kembali. Lihat gambar cara
penambahan air aki di bawah ini.
Gambar 16 : Cara Penambahan Air Aki
Susunan akumulator yang akan disetrum (diisi)
dalam keadaan masih kosong, yaitu
o Kutub positif (anode) terbuat dari timbal
dioksida (PbSO4),
o Kutub negatif (katode) terbuat dari timbal
murni (PbSO4),
o Larutan elektrolit terbuat dari asam sulfat
(H2SO4) encer.
Reaksi kimia saat akumulator diisi, yaitu
o Pada elektrolit : H2SO4 →2H+ + SO4 2
o Pada anode : PbSO4 + SO4 2– + 2H2O→ PbO2
+ 2H2SO4
o Pada katode: PbSO4 + 2H+ → Pb + H2SO4
Jadi, saat penyetruman akumulator pada
prinsipnya mengubah anode dan katode yang berupa timbal sulfat (PbSO4) menjadi
timbal dioksida (PbO2) dan timbal murni (Pb).
H. REAKSI ELEKTROKIMIA PADA BATERAI KERING
Elemen kering disebut juga baterai. Elemen kering
pertama kali dibuat oleh Leclance. Bagian utama elemen kering adalah
o Kutub positif (anode) terbuat dari batang
karbon (C),
o Kutub negatif (katode) terbuat dari seng (Zn),
o Larutan elektrolit terbuat dari amonium
klorida (NH4Cl),
o Dispolarisator terbuat dari mangan dioksida
(MnO2).
Baterai disebut elemen kering, karena
elektrolitnya merupakan campuran antara serbuk karbon, batu kawi, dan salmiak
yang berwujud pasta (kering). Batang karbon (batang arang) memiliki potensial
tinggi, sedangkan lempeng seng memiliki potensial rendah. Jika kedua elektrode
itu dihubungkan dengan lampu maka lampu akan menyala. Hal ini membuktikan
adanya arus listrik yang mengalir pada lampu. Ketika lampu menyala, larutan
elektrolit akan bereaksi dengan seng. Adapun, reaksi kimia pada batu baterai
adalah sebagai berikut.
o Pada larutan elektrolit terjadi reaksi Zn +
2NH4Cl → Zn2+ + 2Cl + 2NH3 + H2 (ditangkap dispolarisasi)
o Pada dispolarisator terjadi reaksi H2 + 2MnO2
→ Mn2O3 + H2O
Reaksi kimia pada batu baterai akan
menghasilkan gelembung-gelembung gas hidrogen (H2). Gas hidrogen akan ditangkap
dan bereaksi dengan dispolarisator yang berupa mangan dioksida (MnO2)
menghasilkan air (H2O), sehingga pada batu baterai tidak terjadi polarisasi gas
hidrogen yang mengganggu jalannya arus listrik. Bahan yang dapat menghilangkan
polarisasi gas hidrogen disebut dispolarisator. Adanya bahan dispolarisator
pada batu baterai, menyebabkan arus listrik yang mengalir lebih lama. Setiap
batu baterai menghasilkan tegangan 2,1 volt. Elemen kering (batu baterai)
banyak dijual di toko karena memiliki keunggulan antara lain tahan lama (awet),
praktis karena bentuk sesuai kebutuhan, dan tidak membasahi peralatan karena
elektrolitnya berupa pasta karena sifatnya kering.
I. CARA MEMBACA KODE BATERAI
Setiap aki punya kode yang bisa dilihat
langsung pada akinya.
Perbedaan standar bisa dilihat pada letak kepala aki (kutub): tenggelam untuk aki tipe DIN dan muncul untuk aki tipe JIS (lebih tinggi).
Perbedaan standar bisa dilihat pada letak kepala aki (kutub): tenggelam untuk aki tipe DIN dan muncul untuk aki tipe JIS (lebih tinggi).
- Japan
Industrial Standard (JIS)
- Deutsches Institut für Normung (DIN)
Gambar 17 : Aki Japan Industrial Standard
(JIS)
Contoh 1: Aki NS40ZLS
o N = Normal
o S = pengurangan daya aki sebesar 20%
o 40 = daya utama aki
o Z = penambahan daya aki sebesar 10% setelah
dikurangi 20% (huruf S pertama)
o L = left, artinya pole (kepala aki / kutub
negatif) [-]) berada di sebelah kiri.
Tanpa kode ini pole pasti berada di sebelah kanan.
Tanpa kode ini pole pasti berada di sebelah kanan.
o S = aki memiliki kutub ukuran besar
Jadi aki NS40ZLS mempunyai daya: 40Ah – 20% +
10% = 32 Ah dengan pole sebelah kiri dan kepala aki besar.
Contoh 2: Aki N 40
o Daya utama 40Ah
o Kepala aki besar, walaupun tidak memiliki kode
S dibelakangnya.
Hal ini karena huruf awalnya bukan NS.
Hal ini karena huruf awalnya bukan NS.
Contoh lain:
o Aki NS 40: kapasitas 32 Ah
o Aki NS 40 Z: kapasitas 35 Ah
o Aki NS 40 ZS: kapasitas 35 Ah dengan kepala
aki besar
Sekarang ini kode di atas mengalami perubahan
menjadi lebih simpel. Seperti NS 40 menjadi 32B20R, artinya:
o 32 : kapasitas aktual aki 32 Ah
o B : kode baterai
o 20 : panjang aki 20cm
o R : posisi pole di sebelah kanan
Gambar 18 : Aki Deutsches Institut für Normung
(DIN)
Aki DIN banyak digunakan untuk mobil buatan
Eropa. Aki ini menggunakan kode 5 digit angka. Tapi yang perlu diperhatikan
hanya 3 digit angka di depan. Cara membacanya:
o Angka I 5 menjadi 0
o Angka I 6 menjadi 1
o Angka I 7 menjadi 2
Contoh: Aki 54533
A. Angka I 5: menjadi angka 0
B. Angka II & III 45 = tetap angka 45
Kapasitas (daya) aki adalah 045 Ah = 45 Ah
Contoh lain: Aki 73530
Kapasitas aki adalah: 235 Ah.
Kapasitas aki adalah: 235 Ah.
Kode Produksi Aki
* Aki Yuasa
Menggunakan penomoran 7 digit. Dua nomor
pertama adalah kode hari, dua angka berikut tanda bulan produksi, dua angka
berikut tahun produksi, dan angka terakhir kode negara produksi. Contoh: Kode
tanggal 2106049
Artinya aki ini diproduksi hari ke-21, di bulan ke-6, di tahun 2004, dan diproduksi di Indonesia.
Artinya aki ini diproduksi hari ke-21, di bulan ke-6, di tahun 2004, dan diproduksi di Indonesia.
Contoh : 65D26R
o 65 = kapasitas baterai (AH)
o D = lebar x tinggi (yang memiliki nilai 173 x
204 mm)
o 26= panjang baterai (cm)
o R = Kutub negatif ada disamping kanan (-)
NS70
o N = Normal
o S = pengurangan daya aki sebesar 20%
o 70 = daya utama aki
Jadi NS70 = 65 AH = 12 V (DC)
J. PEMERIKSAAN VOLUME LARUTAN ELEKTROLIT
Upper level = jumlah air aki maksimum
Lower level = jumlah air aki minimum
K. PENGUKURAN BERAT JENIS ELEKTROLIT BATERAI
Gambar 19 : Hydrometer
Gambar 20 : Mengukur Berat Jenis Air Aki
Gambar 21 : Mengukur Berat Jenis Air Aki
Gambar 22 : Hydrometer Tanda Hijau, Putih dan
Merah
Pengukuran dengan hydrometer
Kondisi isian baterai
Penuh
Sedang
Kosong
|
B. J. Elektrolit ( <= Kg/I )
1,26 – 1,28
1,24 – 1,25
1,08 – 1,1
|
Tegangan sel
2,12
1,75
|
Kerusakan sel akibat pensulfatan
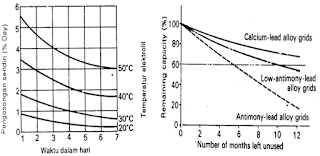
Jika baterai dibiarkan terlalu lama tanpa diisi, maka akan
terbentuk kristal – kristal sulfat yang halus. Tapi karena elektrolit
tidak dapat menguap, maka barulah kristal – kristal itu berubah menjadi kristal
timbel sulfat yang kasar. Kejadian yang demikian disebut pensulfatan.
Pensulfatan bisa menyebabkan pertambahan tahanan dalam dan akan
menghalang – halangi reaksi kimia dalam baterai. Jika dalam keadaan pensulfatan
ini baterai diisi dengan arus, maka baterai menjadi panas dan tegangan tiba –
tiba naik secara tajam
S O A L
Baterai 12 volt dipakai selama 20 jam dengan pemberian arus
konstan 4 Ampere, tegangan akan turun 10,5 volt.
Hitunglah besar kapasitas baterai tersebut.
U = 12 V
t =
20 jam
J = 4 A
U2 = 10,5 V
Penyelesaian :Kapasitas : P = I x t = 4 x 2 = 80 AH
Sebuah mobil sedang diparkir di pinggir jalan. Mobil tersebut
menyalakan lampu besar 12 V/80 W, lampu kota (total) 20 W. Hitunglah waktu
pengosongan jika kapasitas baterai tersebut 84 AH.
Penyelesaian :Daya lampu total
V = 12
V
Pt = P1 + P2
P1 = 80
W
= 80 + 20
P2 = 20
W
= 100 W
Q = 84 AH
L. PENGUKURAN TEGANGAN BATERAI
Gambar 23 : Mengukur Voltage Baterai
menggunakan Volt Meter
Gambar 24 : Membaca Voltage
Kapasitasbaterai
Besaranuntukmenyatakanjumlahmuatanlistrik yang
terkandungdalambateraidisebutkapasitas.Hal
inijugamenentukanbesarkecilnyaukuransuatubaterai.
Kapasitasbateraitergantungpada
:massaaktipdalam plat – plat baterai, jumlahelemen – elemen ,
Luaspenampangpelatbaterai yang terendamdalamelektrolitbaterai
|
Disingkat
Q = I x t
Dimana : Q = Kapasitas (I x t)
I = Aruspemakaian
T = Waktu
Kapasitasspesifik
kapasitasspesifikditentukanolehbesarnyaaruspemakaiselama 20 jam
(10 jam) sehinggateganganselturunmenjadi 1,75 volt.
Beratjeniselektrolit
Beratjeniselektrolit ( r )
dapatdijadikanpetunjukuntukmengetahuikondisiisianbaterai.Sebagaialatpengukurberatjenisinidigunakanhidrometer.
Jikadarihasilpengontrolanberatjenisantarasel yang satudan yang
lain terdapatperbedaanlebihdari 0,025 Kg/I,
makahalitudisebabkanketidak-samaantinggielektrolitnyalagi.
Jikaberatjenisnyaterlalurendah,
makatelahterjadihubungansingkatataubateraisudahtuaatauterlalukehabisanarus.
Semakin lama bateraidipakai, semakinbanyakkandungan air di
dalamelektrolitnya, akibatnyasemakinkecil / rendahberatjeniselektrolittersebut.
Bilaketinggianelektrolitpadatandanyaterlalurendah,
makabateraiharusditambahdengan air suling.
M. PENGUKURAN ARUS LISTRIK BATERAI
Peserta diklat bisa mengukur arus listrik menggunakan amperemeter.
Ampere meter berfungsi untuk mengukur kuat arus listrik yang
mengalir pada baterai.
N. PERMASALAHAN PADA BATERAI MOBIL
Baterai sering bermasalah pada terminal mengecil, terminal
terjadi dioksidasi, soak, tidak bisa menyimpan arus listrik, pecah, terbakar
dan baterai menguap.
O. PERBAIKAN BATERAI
TUJUAN PEMBELAJARAN :
Peserta bisa menservis baterai, mengukur arus, mengukur tegangan
dan mengukur berat jenis air baterai.
ALAT
· Kotak alat
· Kotak plastik (bak)
· Kuas
· Kaca mata
· Volmeter
· Hidrometer
· Amperemeter (200 A)
· Sikat baja
BAHAN
· Lap
· Air suling
· Vet vaselin
· Baterai
P. CARA PERAWATAN BATERAI
Pengisian lebih dari dua baterai
Pengisian baterai yang lebih dari satu buah dapat dilakukan
dengan dua metode, yaitu :
1) Merangkai secara Paralel
2) Merangkai secara seri
Rangkaian Paralel 2 baterai
1) Buka sumbat bateri tempatkan sumbat pada wadah khusus
agar tidak tercecer. Pelepasan sumbat ini dengan tujuan untuk
sirkulasi uap yang dihasilkan elektrolit saat pengisian, dan
menghindarai tekanan pada sel baterai akibat gas yang
dihasilkan
Gambar 25 : Pengisian 2 baterai secara parallel
2) Hubungkan kabel positip baterai 1 dengan terminal positip
baterai 2 kemudian hubungkan dengan klem positip baterai
charger. Demikian pula untuk terminal negatif. Hati-hati jangan
sampai terbalik, bila terbalik akan timbul percikan api, bila
dipaksa baterai akan rusak, pada battery charger model
tertentu dilengkapi dengan indicator, dimana bila pemasangan
terbalik akan muncul bunyi peringatan.
3) Hubungkan battery charger dengan sumber listrik 220 V
4) Pilih selector tegangan sesuai dengan tegangan baterai, misal
baterai 12 V maka selector digerakan kearah 12 V.
5) Hidupkan battery charger, dan setel besar arus sesuai dengan
kapasitas baterai
6) Besar arus merupakan jumlah arus yang dibutuhkan untuk
baterai 1 dan baterai 2. misalnya untuk mengisi dua baterai 50
AH dibutuhkan arus pengisian sebesar 10% x(2 x50)) = 10 A.,
84
mengisi baterai 50 AH dan 40 AH maka diperlukan arus sebesar
10 % x (40+50) = 9 A.
7) Setel waktu yang diperlukan untuk pengisian (untuk battery
charging yang dilengkapi timer), bila tidak dilengkapi maka
catat waktu mulai proses pengisian. Waktu yang diperlukan
sesuai dari hasil pengukuran berat jenis elektrolit masingmasing
baterai.
8) Bila pengisian sudah selasai, maka mematikan battery charger,
9) Lepas klep battery charger pada terminal baterai, lakukan
terminal negatip dahulu, klem jangan dilepas saat battery
charge masi hidup, sebab akan terjadi percikan api pada
terminal sat dilepas dan menimbulkan ledakan pada baterai
akibat uap baterai terbakar. Uap baterai adalah gas hydrogen
yang mudah terbakar dan mudah meledak.
Rangkaian Seri 2 baterai
1) Buka sumbat bateri tempatkan sumbat pada wadah kusus agar
tidak tercecer. Pelepasan sumbat ini dengan tujuan untuk
sirkulasi uap yang dihasilkan elektrolit saat pengisian, dan
menghindarai tekanan pada sel baterai akibat gas yan
dihasilkan.
Gambar 26 : Pengisian 2 baterai secara seri
2) Hubungkan kabel positip baterai 1 dengan terminal positip
baterai 2 kemudian hubungkan dengan klem positip battery
charger. Demikian pula untuk termianal negatip. Hati-hati
jangan sampai terbalik, bila terbalik akan timbul percikan api,
bila dipaksa baterai akan rusak, pada battery charger model
tertentu dilengkapi dengan indicator, dimana bila pemasangan
terbalik akan muncul bunyi peringatan.
3) Hubungkan battery charger dengan sumber listrik 220 V
4) Pilih selector tegangan sesuai dengan total tegangan baterai,
misal 2 baterai 12 V dirangkai seri maka tegangan menjadi 24
V maka selector digerakan kearah 24 V.
5) Hidupkan battery charger, dan setel besar arus sesuai dengan
kapasitas baterai yang paling kecil. Misalkan besar untuk
mengisi dua baterai 50 AH dibutuhkan arus pengisian sebesar
10% x 50 = 5 A., mengisi baterai 50 AH dan 40 AH maka
diperlukan arus sebesar yang digunakan 10 % x 40 AH = 4 A.
6) Setel waktu yang diperlukan untuk pengisian (untuk battery
charging yang dilengkapi timer), bila tidak dilengkapi maka
catat waktu mulai proses pengisian. Waktu yang diperlukan
sesuai dari hasil pengukuran berat jenis elektrolit masingmasing
baterai.
7) Bila pengisian sudah selasai, maka mematikan battery charger,
8) Lepas klep battery charger pada terminal baterai, lakukan
terminal negatip dahulu, klem jangan dilepas saat battery
charge masi hidup, sebab akan terjadi percikan api pada
terminal saat dilepas dan menimbulkan ledakan pada baterai
akibat uap baterai terbakar. Uap baterai adalah gas hydrogen
yang mudah terbakar dan mudah meledak.
Kelebihan dan Kelemahan Metode Mengisi Baterai Seri
dan Paralel
Metode mengeisi baterai lebih dari satu memiliki kelemahan dan
kelebihan masing-masing.
Kelebihan utama pengisian dengan parallel adalah:
1) tegangan pengisian rendah yaitu 12 V, sehingga rancangan
trafo yang digunakan lebih sederhana.
2) Tetap aman meskipun kapasitas baterai tidak sama
Kelemahan:
1) Tidak mampu menentukan dengan pasti berapa besar arus
yang mengalir ke tiap baterai, sehingga sulit menentukan
waktu pengisian yang tepat
2) Arus listrik yang dialirkan merupakan arus total pengisian,
sehingga arusnya yang mengalir cukup besar sehingga kabel
maupun klem buaya untuk pengisian harus berukuran besar.
Kelebihan rangkaian seri:
1) Mampu menentukan dengan pasti berapa besar arus yang
mengalir ke tiap baterai, sehingga dapat menentukan waktu
pengisian dengan tepat
2) Arus listrik yang dialirkan besarnya sama untuk semua
baterai,
sehingga muda ditentukan waktu pengisiannya.
3) Besar arus pengisian normal berdasarkan kapasitas baterai
yang paling kecil, sehingga arus pengisian kecil dan kabel
maupun klem buaya yang digunakan untuk pengisian dapat
dengan ukuran lebih kecil.
Kelemahan:
1) Tegangan pengisian merupakan total tegangan baterai yang
diisi, misal 4 baterai 12V, berarti tegangan pengisian sebesar
48
V.
2) Tidak tepat digunakan untuk baterai yang kapasitasnya
bervariasi, sebab harus mengikuti arus pengisian baterai yang
kapasitas kecil, sehingga untuk baterai yang kapasitasnya besar
waktu pengisian terlalu lama, dan bila mengikuti baterai
kapasitas besar maka pada baterai yang kapasitasnya kecil
akan mengalami over charging sehingga baterai cepat rusak.
Dengan demikian metode ini kurang tepat untuk baterai dengan
kapasitas yang jauh berbeda.
Pengisian cepat
Pengisian cepat adalah pengisian dengan arus yang sangat
besar. Besar pengisian tidak boleh melebihi 50% dari kapasitas
baterai, dengan demikian untuk baterai 50 AH, besar arus
pengisian tidak boleh melebihi 25 A.
Prosedur pengisian cepat sebenarnya sama dengan
pengisian normal, yang berbedah adalah besar arus pengisian
yang diatur sangat besar. Selain itu juga factor resiko yang
jauh
lebih besar, sehingga harus dilakukan dengan ektra hati-hati.
Contoh saat pengisian normal sumbat baterai tidak dilepas tidak
menimbulkan masalah yang serius sebab temperature pengisian
relative rendah sehingga uap elektrolit sangat kecil, berbedah
dengan pengisian cepat dimana arus yang besar menyebabkan
temperature elektrolit sangat tinggi sehingga penguapan sangat
besar, bila sumbat tidak dilepas kotak baterai dapat melengkung
akibat tekanan gas dalam sel baterai yang tidak mampu keluar
akibat lubang ventilasi kurang.
Gambar 45. Pengisian cepat diatas kendaraan
Pengisian cepat sering dilakukan untuk membantu
kendaraan yang mogok atau sedang dalam proses perbaikan,
sehingga baterai tidak diturunkan dari kendaraan. Pada kasus
pengisian cepat di atas kendaraan yang perlu diingat adalah
lepas
kabel baterai negatip sebelum melakukan pengisian, hal ini
disebabkan saat pengisian cepat tegangan dari battery charging
lebih besar dari pengisian normal, kondisi ini potensial merusak
komponen elektronik dan diode pada alternator.
Perawatan baterai yang baik akan memperpajang usia
baterai, sebab dengan perawatan yang baik kekurangan elektrolit
baterai dapat dihindari, korosi pada terminal baterai dapat
dicegah.
Perawatan baterai meliputi pekerjaan membersihkan
terminal baterai, memeriksa isi dan berat jenis elektrolit
baterai ,
menambah isi baterai bila kurang dan mengisi baterai. Pengisian
dapat dilakukan dengan pengisian normal atau pengisian cepat.
Besar arus pengisian normal adalah 10 % dari kapasitas, arua
pengisian cepat maksimal 50% dari kapasitas baterai.
Pengisian cepat bila tidak
terpaksa jangan dilakukan sebab resiko lebih
besar dan baterai cepat rusak. Pengisian cepat dengan baterai
yang tidak diturunkan dari kendaraan dapat merusak sistem
elektronik dan diode alaternator, sehingga kabel baterai harus
dilepas sebelum pengisian dilakukan.
Pengisian baterai dengan 2 baterai atau lebih dapat
dilakukan secara seri maupun parallel. Masing-masing metode
mempunyai kelebihan masing-masing, namun metode serii lebih
baik karena waktu pengisian dapat ditentukan dengan tepat dan
besar arus pengisian kecil.


























Komentar
Posting Komentar